不良事件管理系统:确保医疗器械安全的新里程碑
引言
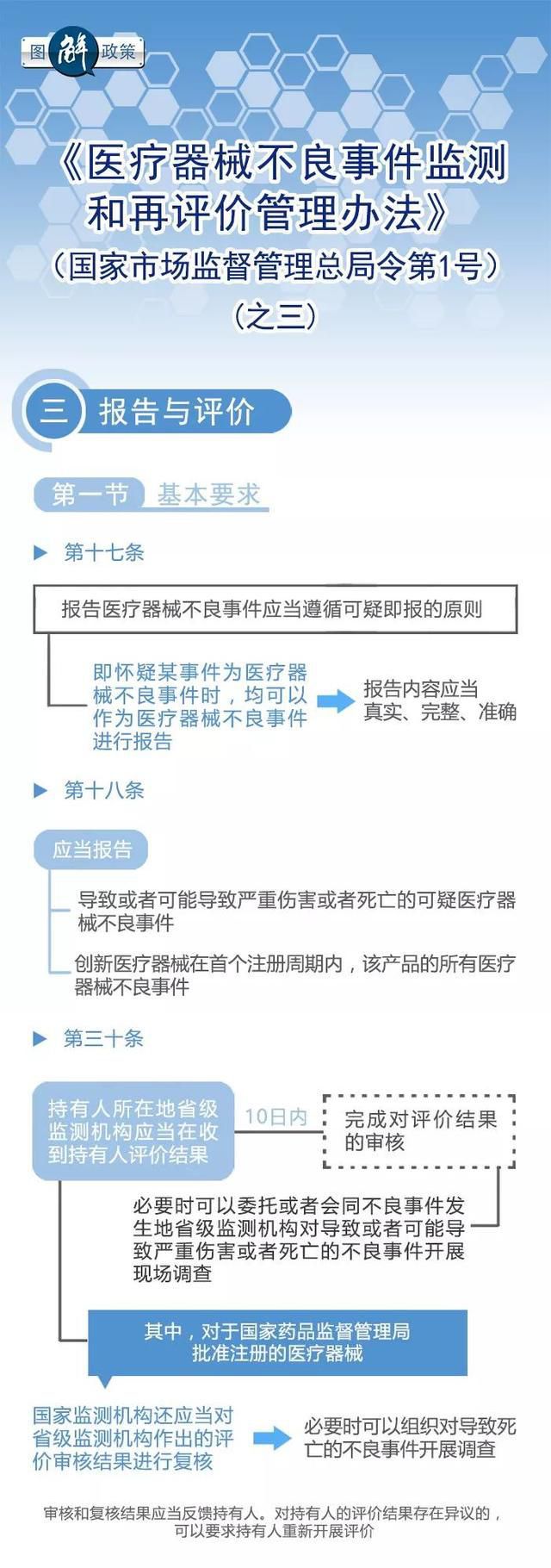
近日,国家市场监督管理总局和国家卫生健康委员会联合发布了《医疗器械不良事件监测和再评价管理办法》. 这份办法共计九章八十条,自2019年1月1日起正式施行。该办法的发布标志着我国医疗器械行业在不良事件管理方面迈出了重要的一步,为确保人民群众的健康安全提供了有力的保障。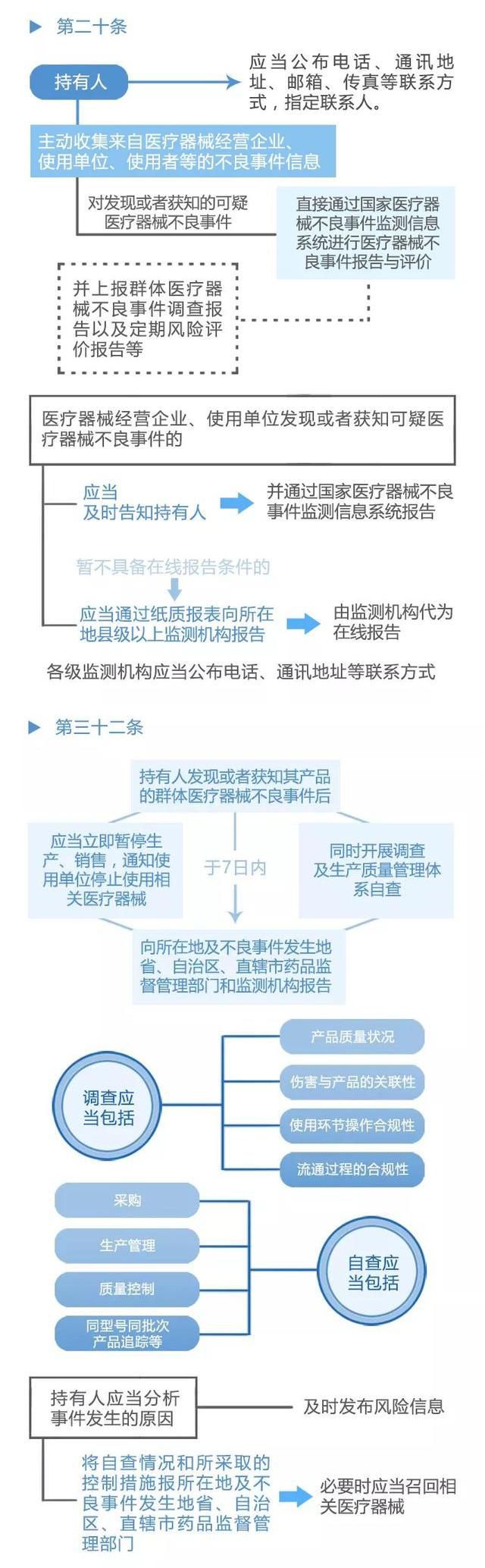
系统构建
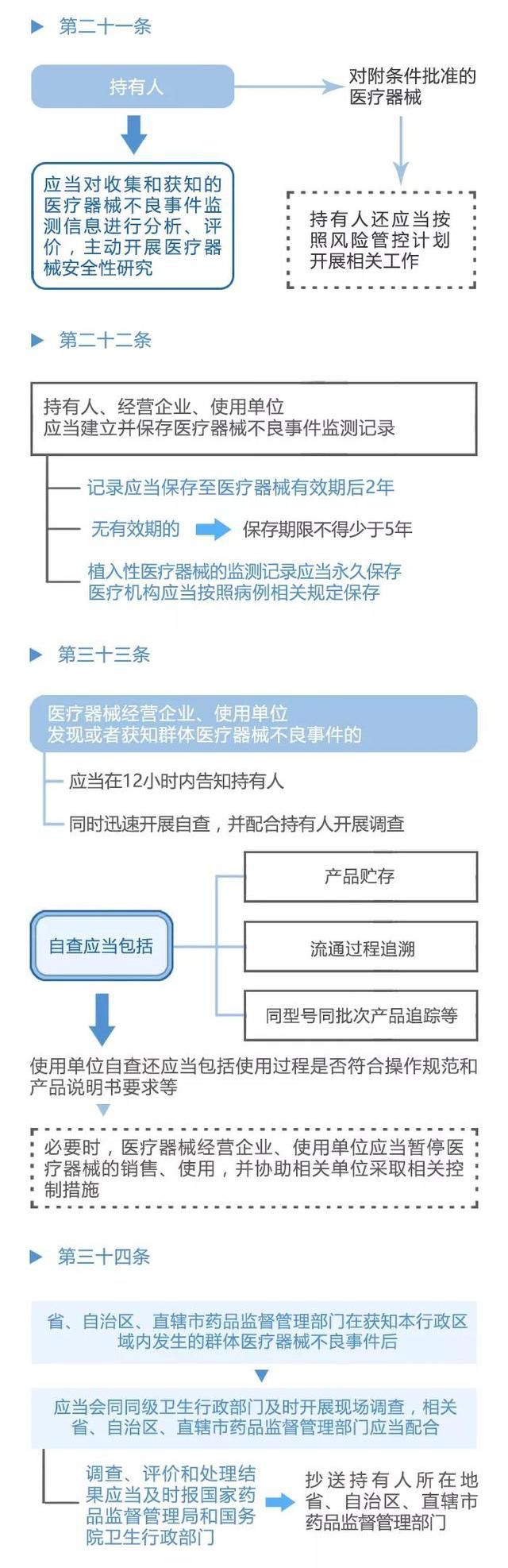
不良事件管理系统是该办法的核心内容之一,它为医疗器械不良事件的监测和再评价提供了有效的管理手段。该系统通过建立健全的信息采集、报告和分析机制,实现对医疗器械不良事件的及时掌握和准确评价. 同时,该系统还提供了举报和反馈渠道,让广大民众参与到医疗器械安全监管中来. 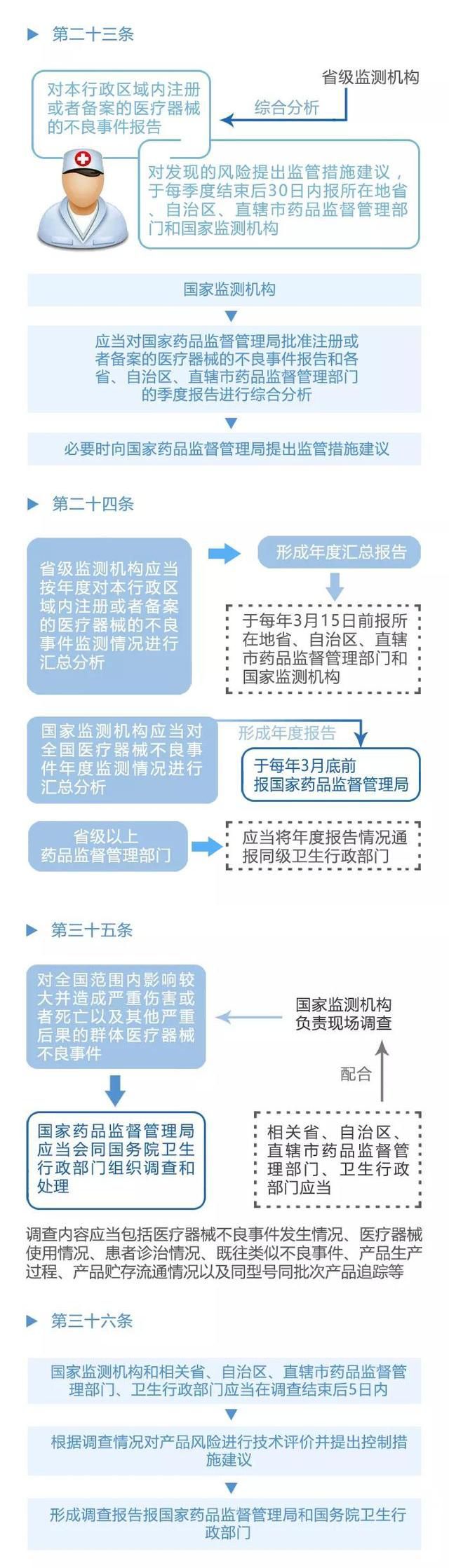
举报/反馈渠道:民众参与监管的重要途径
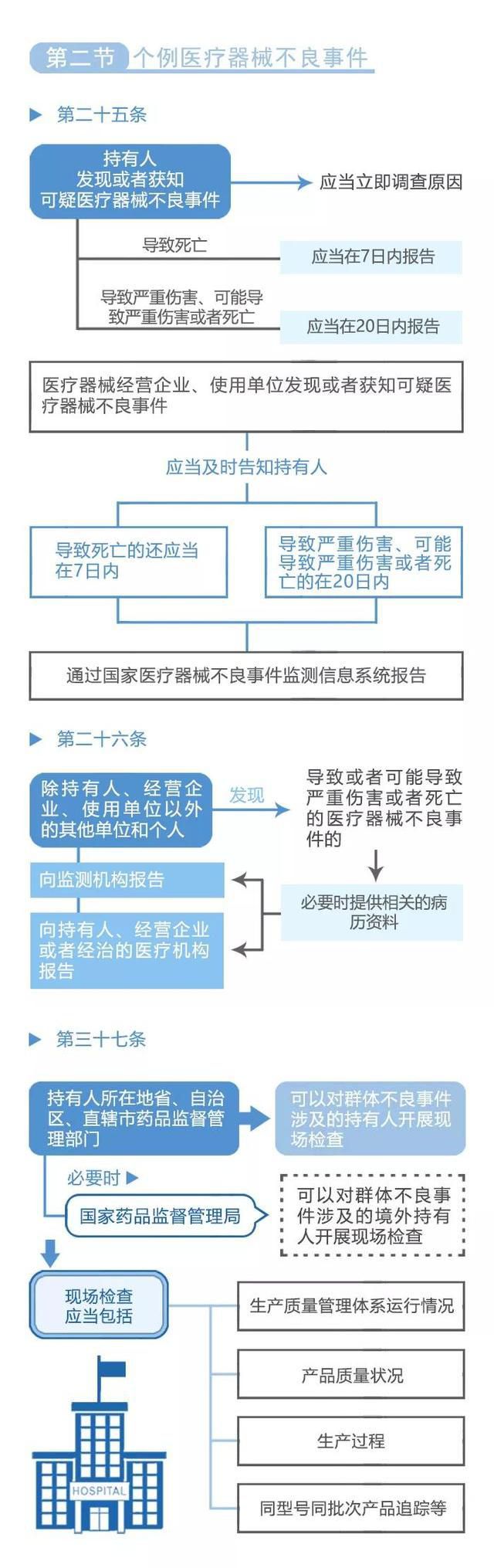
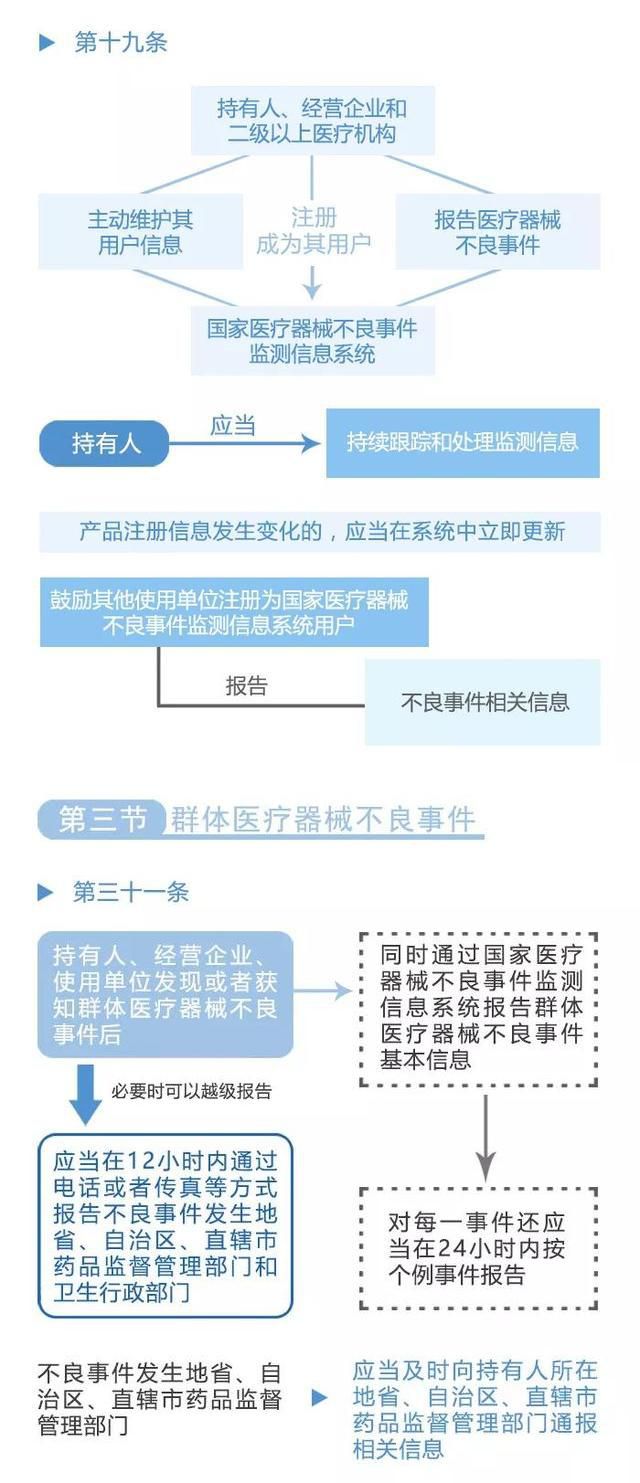
作为不良事件管理系统的重要组成部分,举报和反馈渠道发挥着至关重要的作用. 这一机制让民众可以通过多种途径向有关部门举报医疗器械的不良事件,提供关键的线索和证据,为监管部门提供重要的参考和依据. 同时,举报和反馈渠道也是广大民众参与到医疗器械安全监管中的重要途径,使每个人都能为保障自己和他人的健康安全贡献力量。
办法落地:确保医疗器械安全的关键一环
《医疗器械不良事件监测和再评价管理办法》的发布,标志着我国医疗器械行业在不良事件管理方面迈出了重要的一步. 这份办法的落地实施,将为我国医疗器械行业的发展注入新的动力,加强对医疗器械安全的监管和控制,提高人民群众的健康安全水平. 同时,不良事件管理系统该办法的实施也将推动医疗器械企业提高产品质量和安全性,促进行业的健康发展.
结语
医疗器械不良事件管理的重要性不言而喻,它直接关系到人民群众的生命安全和身体健康. 《医疗器械不良事件监测和再评价管理办法》的发布,为我国医疗器械行业的不良事件管理树立了新的标杆,标志着我国在这一领域迈出了重要的一步. 我们有理由相信,在不久的将来,我国医疗器械行业将以更加安全、可靠的形象呈现在人民群众面前. 让我们共同期待,不良事件管理系统为医疗器械行业的发展带来的更美好的明天!不良事件管理系统.


 咨询在线QQ客服
咨询在线QQ客服 


